小児難治がん研究室
研究室紹介
2024年4月、当センター研究所に『小児がん』および『難治がん』の克服を目指した研究を使命とする『小児難治がん研究室』が開設されました。当研究室では、神経芽腫(副腎・交感神経節から発生する小児がん)の「病態解明」と「難治性症例に対する治療戦略の開発」を柱として研究を展開しています。並行して、難治性の小児骨肉腫や消化器がん(膵臓がんや胃がんなど)を対象とし、私達の先行研究を基盤とした「難治性病態の解明」と「早期診断ならびに革新的な治療戦略の探索」研究を、当院の関係診療科等と共同で推進しています。
構成メンバー
| 上席研究員 | 巽 康年 |
|---|---|
| 研究員 | 宮崎 允 |
| 会計年度任用職員 | 1名 |
| 大学院生 | 1名 |
プロジェクト紹介
(1)神経芽腫の自然退縮と悪性化防止機構の理解とその治療戦略への応用
副腎・交感神経節から発生する小児内分泌腫瘍の神経芽腫(NB)において、難治性NBに対する有効な治療戦略確立が急務である。本研究室では、NBの弱点が潜むと考える病期4Sに特徴的な『自然退縮』に着目し、その分子基盤の解明ならびにその知見を応用した難治性NBに対する革新的な治療戦略の開発を目的として以下の研究を推進する。
1)『自然退縮機構を応用してNBの治療戦略を開発する目的』で、神経芽腫の悪性化防止において鍵となるBMCC1の機能理解を糸口として、自然退縮の分子基盤を明らかにする。
2)『NBの新たな層別化とミトコンドリアを標的とした革新的な治療戦略を開発する目的』で、NB検体の網羅的ミトコンドリアDNA(mtDNA)配列解析を「日本小児がん研究グループ(JCCG)神経芽腫委員会(JNBSG)」と共同で実施し、病態(自然退縮や悪性化)とmtDNA変異との関係を明らかにする。
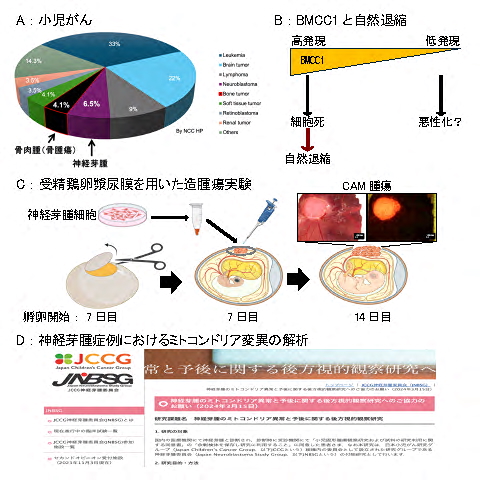
図1.神経芽腫プロジェクトの概要
(A)神経芽腫は脳腫瘍に次いで発症する小児固形腫瘍で、小児がんの6.5%を占める。(B)自然退縮機構を知る為に、鍵分子BMCC1の機能解明を進める。(C)受精鶏卵漿尿膜上に神経芽腫細胞を移植し、腫瘍を形成させる実験系を機能解析研究に導入した。(D)神経芽腫症例が保有するmtDNA 変異についてJNBSGと共同で網羅的に解析中である。
(2)骨肉腫の難治性症例に対する治療戦略の開発
当研究室では、当院整形外科(サルコーマセンター)と共同で、「小児骨肉腫の難治性病態(肺転移と化学療法抵抗性)の解明」と、「その革新的な治療戦略の開発」を目指した研究を進めてきた。小児骨肉腫は小児がんの約4%を占める最も代表的な骨腫瘍である。化学療法抵抗性は腫瘍の悪性化につながり、肺転移は死因の第一位となっている。しかし、これら難治性小児骨肉腫に対する有効な治療法は無い。現在、難治病態に対する治療戦略を発見することを目的とした以下の研究を実施する。
1)『化学療法抵抗性に対する治療戦略を発見する目的』で、先行研究から明らかにした化学療法抵抗症例の特徴を手がかりとして、CDK4依存的・非依存的な術前化学療法耐性機構の解明を目指す。
2)先行研究で発見した肺転移性の原発腫瘍の特徴より着想した『肺転移の予防的な治療戦略を検証する目的』で、その特徴である破綻した骨の恒常性維持機構に関連する遺伝子を標的とすることによる殺細胞ならびに転移抑制効果について検討する。
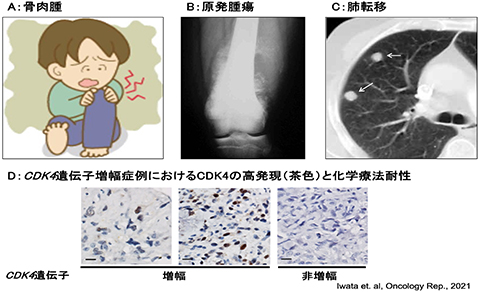
図2.骨肉腫プロジェクトの概要
(A)骨肉腫は小児からAdolescent and Young Adult (AYA)世代にかけて大腿骨や上腕骨など四肢の骨端部に好発する代表的な骨腫瘍である。原発腫瘍(B)の網羅的解析から、肺転移症例(C)の特徴ならびに化学療法抵抗性を持つ症例の特徴である(D)CDK4遺伝子増幅に伴うCDK4の過剰発現(免疫組織染色)が見えてきた。現在はこれら特徴を標的とした難治病態に対する治療戦略を探索中である。
(3)腹膜播種の分子機構の解明および新規治療法の開発
転移はがんによる死亡の主因であり、がん研究における大きな課題の1つです。特に、スキルス胃がんや膵臓がん、卵巣がんで頻発する腹膜播種は、有効な治療法がなく、その分子機構の詳細についても未だ明らかになっていません。私たちは蛍光イメージングや分子細胞生物学、遺伝学等の技術を駆使して、腹膜播種の分子機構の解明および新規治療法の開発を目指して研究に取り組んでいます。最近、私たちは、腹腔内で塊(クラスター)を形成したがん細胞集団が腹膜に接着することで転移巣が形成されることを報告しました(Miyazaki et al. Cancer Lett, 2023, PMID: 36404569)。現在、私たちは、腹腔内がん細胞クラスターに着目し、がん種横断的な腹膜播種機構の解析および新規治療標的の探索を進めています。
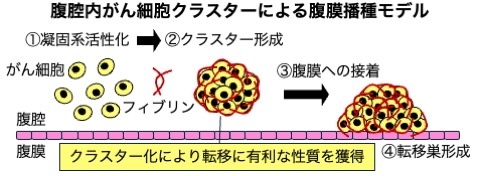
図3.腹腔内がん細胞クラスターによる腹膜播種モデル
腹腔内がん細胞クラスターによる腹膜播種モデル。がん細胞は腹腔内において血液凝固系を活性化しフィブリン繊維形成を誘導します(1)。がん細胞はフィブリン繊維に絡まるようにしてクラスターを形成します(2)。がん細胞クラスターはフィブリン繊維を介して腹膜へ接着し増殖することで転移巣を形成します(3)(4)。私たちはがん細胞のクラスター形成に伴う性質変化に着目し、腹膜播種の分子機構の解析および新規治療標的の探索を行なっています。
業績
- Tatsumi Y, Masuda T, Watanabe T, Utomo RY, Zulfin UM, Meiyanto E, Ozaki T, Suenaga Y, Kamikubo Y., Anti-tumor effect of Curcumin analogs on osteosarcoma through the inhibition of p300-mediated histone acetylation. Oncol Rep., 53: 47, (2025)
- Yamaguchi H, Miyazaki M, Cell biology of cancer peritoneal metastasis: multiclonal seeding and peritoneal tumor microenvironment, Cancer Sci. 13(1):1-19. (2025)
- Yamaguchi H, Miyazaki M, Heterocellular Adhesion in Cancer Invasion and Metastasis: Interactions between Cancer Cells and Cancer-Associated Fibroblasts, Cancers 16(9):1636. (2024)
- Miyazaki M, Nakabo A, Nagano Y, Nagamura Y, Yanagihara K, Ohki R, Nakamura Y, Fukami K, Kawamoto J, Umayahara K, Sakamoto M, Iwaya K, Yamaguchim H, Tissue factor-induced fibrinogenesis mediates cancer cell clustering and multiclonal peritoneal metastasis, Cancer Lett. 553:215983. (2023)
- Miyamoto S, Nagano Y, Miyazaki M, Nagamura Y, Sasaki K, Kawamura K, Yanagihara K, Imai T, Ohki R, Yashiro M, Tanaka M, Sakai R, Yamaguchi H. Integrin α5 mediates cancer cell-fibroblast adhesion and peritoneal dissemination of diffuse-type gastric carcinoma. Cancer Lett., 526; 335-345, (2022)
- Iwata S, Tatsumi Y, Yonemoto T, Araki A, Itami M, Kamoda H, Tsukanishi T, Hagiwara Y, Kinoshita H, Ishii T, Hiroki Nagase H, Ohira M., CDK4 overexpression is a predictive biomarker for resistance to conventional chemotherapy in patients with osteosarcoma. Oncol Rep., 46: 135, (2021)
- Islam MS, Takano R, Yokochi T, Akter J, Nakamura Y, Nakagawara A, Tatsumi Y., Programmed expression of pro-apoptotic BMCC1 during apoptosis, triggered by DNA damage in neuroblastoma cells. BMC Cancer, 19:542, (2019)
- Miyazaki M (co-corresponding author), Otomo R, Matsushima-Hibiya Y, Suzuki H, Nakajima A, Abe N, Tomiyama A, Ichimura K, Matsuda K, Watanabe T, Ochiya T, Nakagama H, Sakai R, and Enari M, The p53 activator overcomes resistance to ALK inhibitors by regulating p53-target selectivity in ALK-driven neuroblastomas. Cell Death Discov., 4: 56. (2018)
- Islam MS, Tatsumi Y, Takano R, Yokochi T, Akter J, Ozaki T, Nakamura Y, Ohira M, Nakagawara A., Transcriptional regulation of BMCC1 mediated by E2F1 in neuroblastoma cells. Biochem. Biophys. Res. Commun., 478, 81-86, (2016)
- Tatsumi Y, Takano R, Islam MS, Yokochi T, Itami M, Nakamura Y, Nakagawara A., BMCC1, which is an interacting partner of BCL2, attenuates AKT activity, accompanied by apoptosis. Cell Death Dis., 6, e1697, (2015)