発がん制御研究部

研究室紹介
発がん制御研究部は生化学研究部の流れを汲み、上条岳彦先生が埼玉県立がんセンター臨床腫瘍研究所長として転出後に筆宝義隆先生(現千葉県がんセンター研究所長)が国立がん研究センターより部長に着任しました。その後、2022年に上久保靖彦が京都大学より部長として着任し、千葉県がんセンター病院との共同研究のもと精力的に活動を展開しています。研究テーマとしては、成人難治性がんおよび小児がんを対象に、発がんメカニズムの解明、新規分子標的の探索、そして革新的治療法の開発を推進しています。特に、白血病をはじめ、膵臓・大腸・乳腺・胃・肺・前立腺・腎・食道・脳腫瘍など多領域のがんを対象に、がん共通の制御原理に基づく次世代精密医療の基盤構築を目指しています。具体的には、転写因子RUNXファミリー(RUNX1/2/3)が多くのがんで高発現し、腫瘍増殖や転移、免疫回避に関与することを見出したことから、これらを包括的に抑制する新概念「CROX法(Cluster Regulation Of RUNX)」を着想しました。実際、CROX法は難治性腫瘍の増殖・転移を効果的に抑え抗腫瘍免疫を賦活する“汎用的がん治療戦略”として、前臨床段階での高い有効性を確認しています。最近では、患者由来オルガノイドや受精鶏卵(CAM)モデルを活用し、新規RUNX阻害剤Chb-M’(開発中)の薬効検証と個別化医療への応用を進めています。
部長からのご挨拶
2022年10月1日に着任させていただきました上久保靖彦と申します。1996年に兵庫医科大学を卒業し、同年京都大学付属病院第一内科に入局、兵庫県立尼崎病院で内科研修医、血液内科専攻医として、白血病や悪性リンパ腫、多発性骨髄腫など血液悪性腫瘍臨床を主に担当させていただきました。その後京都大学大学院医学研究科(内山卓教授)に進学し、堀利行講師のご指導の下、新規細胞周期チェックポイント遺伝子:kpmの単離とその機能解析をテーマとし学位(医学博士)を取得いたしました。
2004年~2009年ヒトゲノムプロジェクトの公的陣営である米国立衛生研究所(NIH)・国立ヒトゲノム研究所(NHGRI)に博士研究員として、フランシス・コリンズ所長&ポール・リュー博士のご指導の下、白血病ノックインマウス(Inv16変異マウス)を6種類樹立し、Inv16白血病の治療ターゲットを同定しました。癌抑制遺伝子RUNXの不完全な抑制は白血病を促進しますが、完全に抑制するとむしろ白血病を抑制できること(白血病における癌抑制遺伝子の逆説的要求性)を発見し提唱いたしました。
2009年東京大学大学院医学系研究科疾患生命工学センター・放射線分子医学講座(宮川清教授)に助教採用、その後同門である東大病院無菌治療部(黒川峰夫教授)へ移動、助教・フロアマネージャーとして血液腫瘍の臨床・教育に従事させていただきました。研究は東京大学血液・腫瘍内科学講座・第6研究室室長に採用いただき白血病発症機構の研究を継続いたしました。
2012年に大阪大学大学院医学系研究科遺伝子治療学講座(金田安史教授・現大阪大学理事・副学長)に助教採用いただき、遺伝子治療学の研鑽を積みました。大阪大学では、多彩な固形腫瘍にも研究対象を広げ、創薬開発法を学ぶことができたことより創薬にも研究を広げることができました。
2013年京都大学大学院医学研究科人間健康科学系専攻准教授、2018年より特定教授として採用されました。癌・創薬イノベーション研究室を主催し、対象癌として、白血病(急性骨髄性白血病:AML、急性リンパ性白血病:PhALL、慢性骨髄性白血病:CML)だけではなく、血液腫瘍ではリンパ腫、固形腫瘍では膵癌、大腸癌、TNBC:トリプルネガティブ乳癌、胃癌(Her2胃癌)、肺癌(EGFR野生型非小細胞性肺癌)、ダブルネガティブ前立腺癌、腎癌(RCC)、食道癌、脳腫瘍では悪性膠芽腫(GBM:悪性グリオブラストーマ)、髄芽腫、小児癌ではMRT(悪性ラブドイド腫瘍)、神経芽細胞腫、骨肉腫まで幅広く研究対象を広げることができました。
これらの癌は、私が提唱する癌抑制遺伝子RUNXファミリーを包括的に抑制すること(CROX法:Cluster Regulation Of RUNX法と命名)で細胞増殖を抑制することが可能です。CROX法により、抗腫瘍免疫も生体内で活性化し、また転移が強力に抑制されますので、その抗腫瘍における万能性を現在テーマとし研究を続けています(万能制癌性と命名)。
千葉県がんセンターには、新規三次元培養法を用いた研究、がんゲノム研究、マウスモデル研究など多彩な世界的な専門家が集積しています。今後は千葉県がんセンター病院、研究所各部門と共同し多彩な技術をさらに用いることで、千葉県から世界に新しく革新的な研究、特にオリジナルな万能制癌コンセプトを発信できるように日々努力いたします所存です。県民の皆様からも、これまで以上に温かい応援をいただけますよう重ねてお願い申し上げます。
構成メンバー
| 部長 | 上久保 靖彦 |
|---|---|
| 研究員 | 渡部 隆義 |
| 博士研究員(学振PD) | 1名 |
| 会計年度任用職員 | 1名 |
| 派遣職員 | 2名 |
プロジェクト紹介
(1)各種難治性癌におけるRUNX遺伝子群-Factor Xアキシスの同定とCROX法による制御戦略の構築
RUNX1癌抑制遺伝子が白血病発症に逆説的に必要であることを世界に先駆けて報告しました(Cancer Cell, 2010; Blood, 2013)。さらに、RUNXファミリー蛋白総量が細胞内で一定に維持される「RUNX遺伝子補償セオリー」を提唱し(J Clin Invest, 2017ほか)、RUNXファミリーによる発がん機能の制御が白血病や固形腫瘍を抑制することを明らかにしました(Blood Adv, Sci Rep等)。これらの知見を基盤に、RUNXファミリー全体を包括的に制御する新戦略「CROX法」を提唱しています。現在、白血病、肺がん、胃がん、神経芽細胞腫、大腸がん、乳がん、前立腺がん、悪性膠芽腫、髄芽腫、悪性ラブドイド腫瘍、骨肉腫など多様な難治性腫瘍において、RUNX遺伝子群と新規バイオマーカー(予後因子)の関係性を示すアキシスを同定中です。これにより、RUNXファミリーを標的とした新たな治療戦略の確立を目指しています。
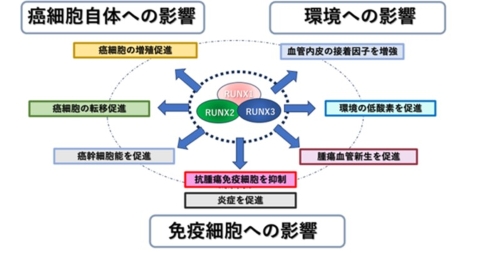
図1. RUNXの機能
RUNX遺伝子群(RUNX1/2/3)は、腫瘍増殖・転移・免疫逃避に重要な役割を果たします。これを包括的に抑制することで、様々ながんの進行を効果的に抑制可能です。
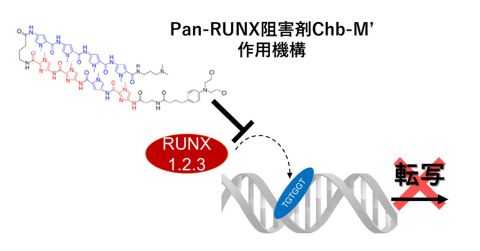
図2. Pan-RUNX阻害剤Chb-M’作用機構
当部開発中のPan-RUNX阻害剤Chb-M’は、RUNX1/2/3の共通DNA配列への結合を阻害し、DNAアルキル化作用によりRUNX遺伝子群を包括的に抑制します。
(2)“CAMELOT: Chick Embryo Model for Oncology Translational Research” Platformの構築
受精鶏卵モデルは、ニワトリの受精卵を用いてヒト腫瘍を忠実に再現する先進的な実験モデルです。従来のマウスモデルに比べ腫瘍形成が迅速で、低コストかつ高効率に研究を進められる点が特長です。免疫が未成熟な受精卵に腫瘍細胞を移植することで、白血病や固形腫瘍の増殖、血管新生、薬剤応答を短期間で観察可能であり、腫瘍発生メカニズムの解明や創薬評価、個別化医療の基盤研究に有用です。当研究部では、このモデルを活用し、新規薬物ライブラリーの候補化合物が腫瘍に特異的に集積し、抗腫瘍効果を示すかをスクリーニングすることで、新薬開発の革新的プラットフォームとして整備しています。柔軟かつ精密な設計により、ヒト腫瘍の複雑な生物学的特性をリアルタイムで追跡できる点も大きな強みです。
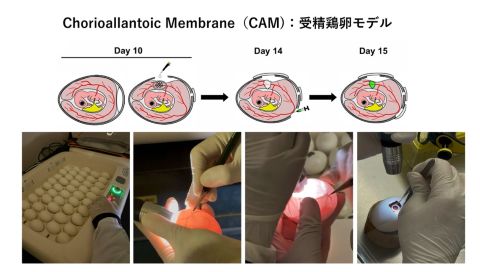
図3.受精鶏卵モデル
鶏卵(CAM)がんモデルは、受精鶏卵を用いてヒトがんを再現する実験系で、短期間で腫瘍形成可能なため、抗がん剤のスクリーニングや前臨床評価に有用です。
(3)新規Pan-RUNX阻害剤(Chb-M’)を用いた直接的及び間接的高齢者AML制御戦略の構築
高齢者急性骨髄性白血病(AML)は、複雑な遺伝子異常や二次性発症が高頻度で、加齢による臓器機能低下や併存疾患により既存治療では十分な生存率が得られず、革新的治療開発が喫緊の課題です。本研究は、白血病の根幹を担うRUNXファミリーを世界で初めて直接標的化し、高齢者AML制御の新規戦略を確立します。既存低侵襲療法との併用により、治療効果と限界を科学的に明確化し、最適化された治療法を提示します。さらに、患者由来細胞を用いたCAMモデルにより、体内環境に近い条件で薬剤を迅速かつ効率的に評価可能です。本研究は、高齢者AMLに対する個別化治療の実現と生存率向上に直結し、臨床・社会に革新をもたらす挑戦的研究です。
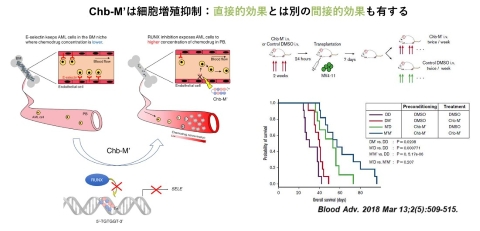
図4.Chb-M’によるAML細胞の骨髄生着抑制効果
Pan-RUNX阻害剤(Chb-M’)はAML細胞の増殖を直接抑制するだけでなく、骨髄血管内皮ニッチのE-Selectin発現を低下させ、MRDを抑制することでAMLを間接的にも制御します。
業績
- Tatsumi Y, Masuda T, Watanabe T, R.Y. Utomo, U.M. Zulfin, E.Meiyanto , Ozaki T, Suenaga Y, Kamikubo Y Antitumor effect of curcumin analog on osteosarcoma through the inhibition of p300‑mediated histone acetylation Oncol Rep. (2025)
- Masuda T, Watanabe T, Tatsumi Y, Lin J, Okumura K, Ozaki T, Sugiyama H, Kamikubo Y Cancer Accumulation and Anticancer Activity of "CROX (Cluster Regulation of RUNX)" PIP in HER2-Positive Gastric Cancer Evaluated by Chicken Egg Cancer Model Cancer Med. (2025)
- Mikami M, Masuda T, Noura M, Kanatani T, Umeda K, Hiramatsu H, Kubota H, Daifu T, Iwai A, Hattori E, Furuichi K, Takasaki S, Tanaka S, Matsui Y, Matsuo H, Hirata M, Kataoka R T, Nakahata T, Kuwahara Y, Iehara T, Hosoi H, Imai Y, Takita J, Sugiyama H, Adachi S and Kamikubo Y RUNX1-Survivin axis as a novel therapeutic target for Malignant Rhabdoid Tumor Mol Cells. (2022)
- Yamamoto E, Masuda T, Mineharu Y, Mikami M, Terada Y, Matsui Y, Masud T, Kubota H, Matsuo H, Hirata M, Kataoka R T, Nakahata T, Ikeda S, Arakawa Y, Sugiyama H, Adachi S, Miyamoto S, Kamikubo Y RUNX-targeted “Gene Switch technology” regulates glioblastoma Commun Biol. (2022)
- MasudaT, Maeda S, Shimada S, Sakuramoto N, Morita K, KoyamaA, Suzuki K, Mitsuda Y, Matsuo H, Kubota H, Kato I, Tanaka K, Takita J, Hirata M, Kataoka TR, Nakahata T, Adachi S, Hirai H, Mizuta S, Naka K, Imai I, Kimura S, Sugiyama H and Kamikubo Y RUNX1 transactivates BCR-ABL1 expression in Philadelphia chromosome positive acute lymphoblastic leukemia Cancer Sci. (2021)
- Daifu T, Mikami M, Hiramatsu H, Iwai A, Umeda K, Noura M, Kubota H, Masuda T, Furuichi K, Takasaki S, Noguchi Y, Morita K, Bando T, Hirata M, Kataoka TR, Nakahata T, Kuwahara Y, Iehara T, Hosoi H, Takita J, Sugiyama H, Adachi S, and Kamikubo Y Suppression of malignant rhabdoid tumors through Chb-M’-mediated RUNX1 inhibition Pediatr Blood Cancer. (2021)
- Tokushige C, Morita K, Maeda S, Kiyose H, Noura M, Iwai A, Yamada M, Kashiwazaki G, Taniguchi J, Bando T, Hirata M, Kataoka T.R, Nakahata T, Adachi S, Sugiyama H and Kamikubo Y RUNX transcription factors potentially control E-selectin expressions in the vascular niche of mice bone marrow. Blood Adv. (2018)
- Morita K, Maeda S, Suzuki K, Kiyose H, Taniguchi J, Liu P.P., Sugiyama H, Adachi S and Kamikubo Y Paradoxical enhancement of leukemogenesis in acute myeloid leukemia with moderately-attenuated RUNX1 expressions. Blood Adv. (2017)
- Morita K, Suzuki K, Maeda S, Matsuo A, Mitsuda Y, Tokushige C, Kashiwazaki G, Taniguchi J, Maeda R, Noura M, Hirata M, Kataoka T.R, Yano A, Yamada Y, Kiyose H, Tokumasu M, Matsuo H, Tanaka S, Okuno Y, Muto M, Naka K, Ito K, Kitamura T, Kaneda Y, Liu P.P, Bando T, Adachi S, Sugiyama H and Kamikubo Y Genetic regulation of the RUNX transcription factor family has antitumor effects. J Clin Invest. (2017)
- Kamikubo Y, Sood R and Liu P.P Role of RUNX1 in hematological malignancies. Blood. (2017)