がん先進治療開発研究室

研究室紹介
がん先進治療開発研究室では標的治療薬の開発が進んでいないがんに対する新たな治療戦略の構築およびがん診断に使える新たなマーカーの探索に関する研究を行っています。本研究室は古くは生化学研究部の流れを汲み、生化学・分子生物学の手技を駆使して、小児がんの一つである神経芽腫の発生原因となる遺伝子異常の発見および発がんメカニズムにおける遺伝子機能の解明を目指した研究を行ってきました。2019年より高取が室長となり、AMED支援の研究課題2件を中心に、神経芽腫を含む小児がんや難治性がんの研究に引き続き取り組んでいます。
構成メンバー
| 室長 | 高取 敦志 |
|---|---|
| 会計年度任用職員 | 4名 |
| 大学院生 | 2名 |
プロジェクト紹介
(1)小児がんおよび難治性がんにおけるundruggableなゲノム異常に対する新規治療戦略の構築
神経芽腫を含む小児がんは症例数が少ないこともあり、がん研究の中では発がんメカニズムの理解も治療法開発も大人のがんに比べて十分ではありません。本研究室では日本の神経芽腫および小児肝腫瘍の検体保存・配布を行うバイオバンク事業の一端を担っていることもあり、日本小児がん研究グループと連携しながら、小児がんの発がんメカニズムを明らかにする研究をさらに推進していきます。
これまでのがん分子標的治療薬開発は、受容体型チロシンキナーゼなどの特異的阻害剤を中心に進んできました。一方で、小分子化合物では標的としにくい分子、いわゆるundruggableな標的に対する薬剤開発は遅れているのが現状です。さらに小児がんや希少がんと呼ばれる症例数の少ないがん種は、治療薬開発研究が少ないこともあり、未だに分子標的治療薬がみつかっていないアンメットメディカルニーズが高い疾患となっています。このような現状を打破するべく、我々はundruggableな標的の中でも特に核内で働くがん遺伝子に注目し、それらをdruggableな標的に変えるべく研究に取り組んでいます。
(2)ミトコンドリア機能異常に対する早期介入・治療法の開発研究
細胞小器官の一つであるミトコンドリアはその呼吸鎖の働きによりエネルギーを産生するが、その過程で発生する活性酸素種などによりミトコンドリアDNA(mtDNA)が傷つき、このDNA変異が蓄積することで生活習慣病や老年病の発症、がんの悪性化につながるのではないかとして注目されてきました。我々は、これまでのリキッドバイオプシーでは捉えることが難しい微量のmtDNAを少量の体液中から検出する方法を研究しています(AMEDムーンショット事業)。
また、がんの研究所としては珍しく化合物合成を行う施設を有しており、DNAに直接作用することでmtDNA変異を標的化する新規化合物に関する研究を進めています(AMED難治性疾患等実用化研究事業)。
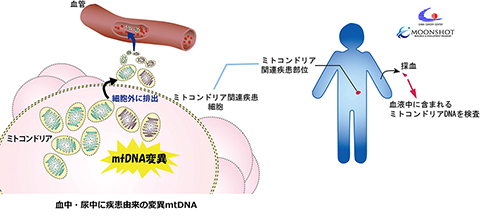
図1.AMED ムーンショット型研究開発事業(目標7)「ミトコンドリア先制医療」
体液中の微量のmtDNAを検出する方法を開発することにより、自分のミトコンドリアの状態を知ることができる簡便な検査法の構築を目指します。(Kitagawa Y, et al., Scientific Reports, 2019;高取 敦志、他. 医学のあゆみ, 2022)
業績
- Qiao Y, Kida Y, Lai X, Koshikawa N, Igarashi R, Takatori A, Takenaga K. Anticancer Effect of the Triphenylphosphonium-Conjugated Quinolone Antibiotics Targeting Mitochondrial DNA Replication. Cancer Science, doi: 10.1111/cas.70199 (2025)
- Lai X, Yoda H, Qiao Y, Kida Y, Takenaga K, Shinozaki Y, Koshikawa N, Takatori A. ATR inhibition synergizes with alkylating PI polyamide targeting MYCN by suppressing DNA repair in MYCN-amplified neuroblastoma. Cancer Science, 116:6:1691-1702 (2025)
- I Ikeda H, Kawase K, Nishi T, Watanabe T, Takenaga K, Inozume T, Ishino T, Aki S, Lin J, Kawashima S, Nagasaki J, Ueda Y, Suzuki S, Makinoshima H, Itami M, Nakamura Y, Tatsumi Y, Suenaga Y, Morinaga T, Honobe-Tabuchi A, Ohnuma T, Kawamura T, Umeda Y, Nakamura Y, Kiniwa Y, Ichihara E, Hayashi H, Ikeda JI, Hanazawa T, Toyooka S, Mano H, Suzuki T, Osawa T, Kawazu M, Togashi Y. Immune evasion through mitochondrial transfer in the tumour microenvironment. Nature, 638:225-236 (2025)
- Lai X, Yoda H, Qiao Y, Kida Y, Takenaga K, Shinozaki Y, Koshikawa N, Takatori A. Poly (ADP-ribose) polymerase inhibitor sensitized DNA damage caused by an alkylating pyrrole-imidazole polyamide targeting MYCN in neuroblastoma cells. Biochem Biophys Res Commun., 735:150794 (2024)
- Tsujimoto A, Matsuo N, Lai X, Inoue T, Yoda H, Lin J, Shinozaki Y, Watanabe T, Koshikawa N, Takatori A, Nagase H. Use of DNA-alkylating pyrrole-imidazole polyamides for anti-cancer drug sensitivity screening in pancreatic ductal adenocarcinoma. Cancer Medicine, 12(5):5821-5832 (2023)
- Ota Y, Yoda H, Inoue T, Watanabe T, Shinozaki Y, Takatori A, Nagase H. Targeting anaplastic lymphoma kinase (ALK) gene alterations in neuroblastoma by using alkylating pyrrole-imidazole polyamides. PLoS One, 16(9):e0257718 (2021)
- Takatori A, Hossain MS, Ogura A, Akter J, Nakamura Y, Nakagawara A. NLRR1 is a potential therapeutic target in neuroblastoma and MYCN-driven malignant cancers. Frontiers in Oncology, 25;11:669667 (2021)
- Krishnamurthy S, Yoda H, Hiraoka K, Inoue T, Lin J, Shinozaki Y, Watanabe T, Koshikawa N, Takatori A, Nagase H. Targeting the mutant PIK3CA gene by DNA-alkylating pyrrole-imidazole polyamide in cervical cancer. Cancer Science, 112(3):1141-1149 (2021)
- Yoda H, Inoue T, Shinozaki Y, Lin J, Watanabe T, Koshikawa N, Takatori A, Nagase H. Direct Targeting of MYCN Gene Amplification by Site-Specific DNA Alkylation in Neuroblastoma. Direct targeting of MYCN gene amplification by site-specific DNA alkylation in neuroblastoma. Cancer Research, 79(4):830-840 (2019)
- 高取 敦志、竹永 啓三. ミトコンドリアゲノム標的薬剤によるミトコンドリア関連疾患の治療法開発. 医学のあゆみ, 281(12), 1135-1139 (2022)