実験動物研究部

研究室紹介
実験動物研究部の部長を務めています若林雄一と申します。実験動物研究部の源流は旧生化学研究部動物管理室にさかのぼります。初代室長は時田尚志先生が務められ、原口清輝先生、藤谷昌司先生と引き継がれたのち、平成23年4月から若林が着任し、平成31年3月まで室長を務めました。途中、改組に伴い、発がん研究グループ実験動物研究室と名称変更されましたが、平成31年4月よりがんゲノムセンターに移行し、現在の実験動物研究部となりました。
ここから私自身のことについてご紹介したいと思います。私は、最近、世界遺産登録がスムーズに進まないことが何かと話題になる佐渡金山のある佐渡島で高校卒業まで過ごしました。進路がなかなか決められなかった私は父の強い希望に従い、卒業後は海を渡って地元の新潟大学の医学部に進学しました。こんなことを言うと申し訳ない気もしますが、正直、医師になりたい強い思いを持って、希望に満ち溢れて・・・というよりは、“渋々”と進学したというほうが正確だと思います。そんな調子なので、入学当初の私は基礎医学と臨床医学の区別もつかない有様でした。本当に医者になるのかなあというような漠然とした考えのまま、数年間を過ごした後、大学の生化学の講義で聞いた木南 凌教授(当時)の分子生物学の講義に目が覚めるような思いがしました。今、思えば内容を理解してというよりは、その時々のトピックスを紹介する講義スタイルがとても新鮮だったように思います。これが私の研究者人生のすべての始まりでした。早速、ワトソンのMolecular Biology of the Geneを買って自分でも勉強し、生化学教室にも出入りするようになり、大学卒業後はすぐに生化学教室の大学院生となり、マウスを使った研究を始めました。当初からがん研究を行っていたわけではなく、難聴マウスの原因遺伝子の探索をテーマとしました。当時はまだゲノムプロジェクト完成前で、原因遺伝子不明の変異マウスが数多く、存在していました。ところがそれらのマウスは市販されて市場に出回っており、世界中の誰もが手に入れられる、つまり、非常にコンピートしやすい危険な状況でもありました。その不安はものの見事に的中してしまいました。大学院生活も終わりに近づいた頃、同じマウスの原因遺伝子を標的としていたアメリカのグループから論文が発表されてしまいました。かろうじて途中経過をまとめた論文で学位をいただき、すぐに助手(今の助教)にもしていただきましたが、難聴マウス敗北のショックはあまりにも大きく、何もやる気が起きませんでした。難聴の研究はもうできなくなってしまったので、そこでまた、“渋々”と当時、生化学教室で行われていた放射線誘発胸腺リンパ腫の研究を始めました。これが私とがん研究との“悲しい”出会いです。その数年後にアメリカに渡り、カリフォルニア大学サンフランシスコ校のAllan Balmain labで野生マウスや皮膚化学がんモデルの研究を行いました。その頃にはゲノムプロジェクトが完成してそれまでのゲノムのマッピングなどの研究が実質、終焉を迎えていました。日本のマウス研究者は便利さを喜ぶというよりは、むしろ戸惑っている雰囲気でした。ところがAllan Balmainは全く違い、新しい時代に生き生きとしており、国が違うとこうも違うものかと驚きました。そこで過ごした約6年間で完全にがん研究にシフトし、その経験が現在、実験動物研究部で行われている研究のベースとなっています。
構成メンバー
| 部長 | 若林 雄一 |
|---|---|
| 研究員 | 奥村 和弘 |
| 研究員 | 齋藤 慈 |
| 会計年度任用職員 | 2名 |
| 動物室(委託) | 3名 |
| 大学院生 | 2名 |
プロジェクト紹介
(1)マウス系統間における発がん抵抗性/感受性遺伝子の探索
マウスには400種を超える近交系系統が樹立されており、がんに対する感受性が系統ごとに異なります。特に野生由来近交系マウスは、一般的な実験用マウスと比較して発がん抵抗性が強い傾向があります。当研究部では日本産野生由来近交系マウスであるMSM/Ms系統がDMBA/TPA多段階皮膚発がんに対して強力な抵抗性であることを証明しました。そこで、MSM/Msの発がん抵抗性遺伝子(群)を同定するために順・逆遺伝学的手法を駆使して研究を行っています。発がん感受性系統であるFVB/NとMSM/MsとのN2マウスを約200頭程度作製し、それらマウスの発がん表現型と全ゲノム遺伝子型データを用いた連鎖解析により、Skin Tumor Modifier of MSM(Stmm)遺伝子座を12箇所ゲノム上にマップすることに成功しました(図1A)。その後、いくつかの遺伝子座においては候補領域をコンジェニック・マッピングにより特定のゲノム領域に狭めました。特に発がん抵抗性の効果が強いStmm1a、Stmm1bおよび後期腫瘍悪性化に対して抵抗性を示すStmm3の原因遺伝子を同定し、MSM/Msの発がん抵抗性の分子メカニズムを明らかにしてきました(図1B)。今後も未同定のStmm遺伝子座の原因遺伝子を明らかにするために本プロジェクトに取り組んでいきます。
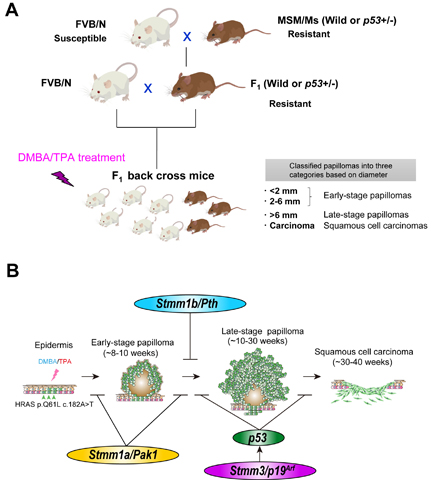
図1. MSM/Msマウスの発がん抵抗性遺伝子(群)を探索するための順遺伝学的アプローチ
A: 発がん感受性系統のFVB/Nマウスと抵抗性系統のMSM/Msマウスを交配し、得られた様々な遺伝子組み換えが起きた子孫集団の発がん感受性を調べて、遺伝的に発がんと連鎖する染色体上の遺伝子を探索する。B: Aの解析によってDMBA/TPA多段階皮膚発がん過程において感受性/抵抗性を与える原因遺伝子を複数同定している。
(2)Stmm1a/Pak1遺伝子の機能解析およびPak1を標的としたがん治療法の開発
当研究部ではMSM/Msマウスを用いた遺伝学的な解析からStmm1aの原因遺伝子としてp21 protein(Cdc42/Rac)-activated kinase 1(Pak1)遺伝子を同定しました。Pak1はセリン・スレオニンキナーゼの一種であり、発がんに重要なRASシグナルパスウェイを調節すること等が知られています。我々は、MSM/MsではFVB/Nに比べてPak1の発現が非常に低いこと、3′非翻訳領域(UTR)の一塩基多型を介した選択的ポリアデニル化の違いがPak1の発現を制御することを提唱し、皮膚発がんにおけるPak1の新たな機能を明らかにしました(図2A)。さらに我々は、PAK1が腫瘍に対する治療標的になると考え、マウス皮下移植モデルによるPAK1阻害剤の治療効果検討も行っています。PAK1特異的阻害剤を皮膚腫瘍細胞移植マウスモデルに投与すると腫瘍抑制効果があることがわかりました(図2B)。今後は、PAK1の腫瘍抑制メカニズムの解明を進めるとともに独自のPAK1阻害剤の開発にも取り組んでいきます。
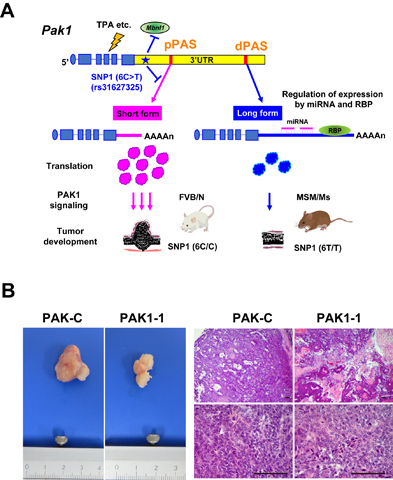
図2. Pak1の3′非翻訳領域の多型による発がん感受性/抵抗性を制御するメカニズムおよびPAK1阻害剤によるマウス皮下腫瘍の治療効果検討
A: FVB/NとMSM/Ms間において3’非翻訳領域の多型(6T/C)が発がん感受性に関与しており、それがPak1のmRNAの選択的ポリアデニル化を介して制御されていることを明らかにした。 B: シンジェニックマウスモデルを用いた、PAK1阻害剤投与によるマウス皮下皮膚扁平上皮がん増殖抑制の検討。PAK1-C(コントロール剤)に比べて、PAK1-1(PAK1特異的阻害剤)では腫瘍の増殖が抑制されている。
業績
- Saito M, Okumura K, Tokunaga Y, Tanaka S, Otoyama K, Hasegawa Y, Hara M, Hashimoto M, Fujimori T, Fukagawa T, Wakabayashi Y. Deletion of the Mis12C-Binding Domain of CENP-C Promotes Chromosomal Aneuploidy in Cutaneous Squamous Cell Carcinoma. Cancer Sci., (2025). Online ahead of print.
- Okumura K, Morinaga T, Saito M, Tokunaga Y, Otoyama K, Tanaka S, Isogai E, Kawazu M, Togashi Y, Hasegawa Y, Wakabayashi Y. Targeting PAK1 is effective against cutaneous squamous cell carcinoma in a syngenic mouse model. Cancer Sci., 115(8): 2839-2845, (2024)
- Okumura K, Morinaga T, Saito M, Tokunaga Y, Otoyama K, Tanaka S, Isogai E, Kawazu M, Togashi Y, Araki K, Wakabayashi Y. Deletion of Pak1 in CD11c positive cells confers resistance to mouse skin carcinogenesis. J Invest Dermatol., 144(8): 1890-1893, (2024)
- Isogai E, Okumura K, Saito M, Tokunaga Y, Wakabayashi Y. Meis1 plays roles in cortical development through regulation of cellular proliferative capacity in the embryonic cerebrum. Biomed Res., 43(3): 91-97, (2022)
- Okumura K, Saito M, Isogai E, Tokunaga Y, Hasegawa Y, Araki K, Wakabayashi Y. Functional polymorphism in Pak1-3'UTR alters skin tumor susceptibility by alternative polyadenylation. J Invest Dermatol., 142(9): 2323-2333, (2022)
- Saito M, Sada A, Fukuyo M, Aoki K, Okumura K, Tabata Y, Chen Y, Kaneda A, Wakabayashi Y, Ohki R. PHLDA3 is an important downstream mediator of p53 in squamous cell carcinogenesis. J Invest Dermatol., 142(4): 1040-1049, (2021)
- Saito M, Kagawa N, Okumura K, Munakata H, Isogai E, Fukagawa T, Wakabayashi Y. CENP-50 Is Required for Papilloma Development in the Two-Stage Skin Carcinogenesis Model. Cancer Sci., 111(8): 2850-2860, (2020)
- Okumura K, Saito M, Yoshizawa Y, Ito Y, Isogai E, Araki K, Wakabayashi Y. Pak1 Maintains Epidermal Stem Cells by Regulating Langerhans Cells and Is Required for Skin Carcinogenesis. Oncogene. 39(24):4756-4769. (2020)
- Saito M, Okumura K, Isogai E, Araki K, Tanikawa C, Matsuda K, Kamijo T, Kominami R, Wakabayashi Y. A polymorphic variant in p19Arf confers resistance to chemically-induced skin tumors by activating the p53 pathway. J Invest Dermatol. 139(7):1459-1469. (2019)
- Okumura K, Saito M, Yoshizawa Y, Munakata H, Isogai E, Miura I, Wakana S, Yamaguchi M, Shitara H, Taya C, Karaplis AC, Kominami R, Wakabayashi Y. The parathyroid hormone regulates skin tumour susceptibility in mice. Sci Rep. 7(1):11208. (2017)