進化腫瘍学研究室

研究室紹介
当研究室は、オルガノイド培養を用いたがんの基礎研究を行っていた旧・発がん制御研究部・末永グループを母体として、2023年に新たに設立されました。私たちは、進化の視点からがんを理解し、その知見に基づいた新しい治療法の開発を目指しています。特に、再発や転移など、がんの「進化可能性」を抑える治療法の確立を目標としています。また、医学・薬学にとどまらず、進化学、脳科学、霊長類学、人類学、構造生物学など、多様な分野の国内外の研究室と連携した共同研究を積極的に推進しています。
構成メンバー
| 室長 | 末永 雄介 |
|---|---|
| 研究員 | 山本 清義 |
| 所長(兼任) | 筆宝 義隆 |
| 会計年度任用職員 | 2名 |
| 派遣職員 | 1名 |
| 大学院生 | 3名 |
| 研修生 | 1名 |
プロジェクト紹介
(1)ヒトにのみ存在する遺伝子 NCYM を標的にした治療薬開発
神経芽腫は主に小児に発症するがんで、交感神経節や副腎から生じます。このがんの増殖には MYCN という遺伝子が深く関与しており、その活性を抑えることが治療に有効であると考えられています。私たちは、その反対側の領域から進化したヒト固有の遺伝子 NCYM が、がんを促進するタンパク質を翻訳することを発見しました(Suenaga et al., PLoS Genetics 2014, 図1)。さらに、NCYM は神経芽腫だけでなく、肝臓がん、胆管がん、肺がんなどの成人がんでも高発現しており、転移や薬剤耐性の原因となることが明らかになっています。2021年度からは東アジアサミット参加国を対象とした国際共同研究グラントe-ASIA に採択されインドネシアおよびオーストラリアの研究室とともに、胆管がんにおける NCYM の機能解析を進めてきました。2025年度からは、ASEAN 創立50周年記念 国際共同研究グラント「NEXUS」 に採択され、肝臓がん・胆管がんの研究を国際チームで推進しています。海外からの留学生も受け入れ、難治性がんの克服を目指しています。
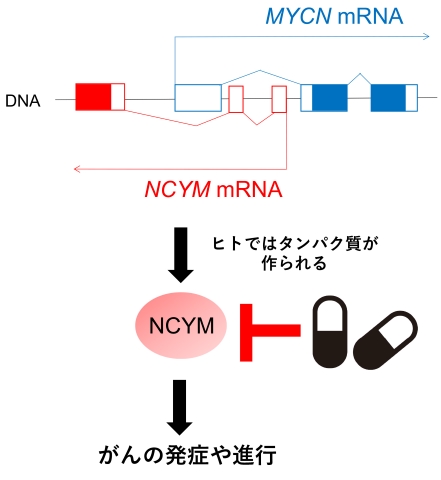
図1.ヒトに特異的ながん遺伝子NCYMの阻害薬
MYCNがん遺伝子の逆方向に重なるようにして存在する遺伝子NCYMはヒトでのみタンパク質を翻訳します。NCYMはがんの発症、進行に関わるため、私たちはその阻害薬の開発を行っています。
(2)新しい遺伝子の誕生とがん進化の研究
解析の結果、NCYM はもともと「タンパク質を作らない RNA(ノンコーディングRNA)」から進化して生まれた、新しいタイプの遺伝子であることが分かりました。
この発見は、「遺伝子はどのように誕生するのか」という生命進化の根本的な問いに対する重要な手がかりを提供します。私たちは、RNA 配列から新しい遺伝子が生まれる可能性を数値化する指標 ORFドミナンス(ORF-D) を開発しました(Suenaga et al., EMBO Reports 2022, 図2)。
この指標を用いた解析により、遺伝子の誕生から種の進化、さらにはがん細胞の進化までを一貫して理解できる可能性が示されています。今後は ORF-D を活用し、がんがどのように治療抵抗性や転移能力を獲得するのか、その進化的メカニズムの解明を目指しています。
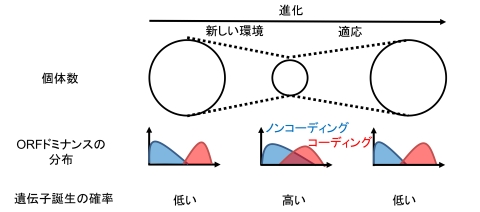
図2. 個体数減少に対抗する進化戦略としての「新しい遺伝子の誕生」
ORFドミナンスを指標として、100種以上の生物種・300万以上のRNAを解析しました。その結果、個体数が減少した生物種では、タンパク質を翻訳するRNA(コーディングRNA)と、翻訳しないRNA(ノンコーディングRNA)の区別が曖昧になり、新しい遺伝子が誕生しやすい状況にあることが分かりました。一方で、環境に適応できる新しい遺伝子が生まれない場合、その生物種は絶滅に至る可能性が高いことも示唆されました。
(3)日本モンキーセンターとの共同研究によるサル類腫瘍研究
私たちは、「なぜヒトではがんの死亡率が高いのか」を明らかにするため、日本モンキーセンターとの共同研究として、ヒトに近いサル類を対象に、がんの発生と新しい遺伝子の誕生との関係を探る研究を進めています。6,500個体を超える剖検記録の解析から、系統間で発がん率や臓器の特徴に違いがみられることを明らかにしました。これらの違いの背景には、新たに誕生した遺伝子の働きが関与している可能性があります。現在、モンキーセンターで得られた貴重な腫瘍検体からオルガノイドを作製し、長鎖RNA解析などの最先端技術を用いて、これらの新規遺伝子の機能解析を進めています。この研究を通じて、進化の過程で生まれた新しい遺伝子が、がんの発症や臓器機能にどのように関わるのかを明らかにし、「進化」と「疾患」の関係を理解することを目指しています。
業績
- Mouhand A, Nakatani K, Kono F, Hippo Y, Matsuo T, Barthe P, Peters J, Suenaga Y*, Tamada T*, Roumestand C*. 1H, 13C and 15N backbone and side-chain resonance assignments of the human oncogenic protein NCYM. Biomol NMR Assign. 18(1):65-70 (2024)
- Nakatani K, Kogashi H, Miyamoto T, Setoguchi T, Sakuma T, Kugou K, Hasegawa Y, Yamamoto T, Hippo Y, Suenaga Y*. Inhibition of OCT4 binding at the MYCN locus induces neuroblastoma cell death accompanied by downregulation of transcripts with high-open reading frame dominance. Front Oncol. 14:1237378 (2024)
- Yamamoto S, Kono F, Nakatani K, Hirose M, Horii K, Hippo Y, Tamada T, Suenaga Y*, Matsuo T*. Structural characterization of human de novo protein NCYM and its complex with a newly identified DNA aptamer using atomic force microscopy and small-angle X-ray scattering. Front Oncol. 13:1213678 (2023)
- Hoshi D, Kita E, Maru Y, Kogashi H, Nakamura Y, Tatsumi Y, Shimozato O, Nakamura K, Sudo K, Tsujimoto A, Yokoyama R, Kato A, Ushiku T, Fukayama M, Itami M, Yamaguchi T, Hippo Y*. Derivation of pancreatic acinar cell carcinoma cell line HS-1 as a patient-derived tumor organoid. Cancer Sci. 114(3):1165-1179 (2023)
- Suenaga Y*, Kato M, Nagai M, Nakatani K, Kogashi H, Kobatake M, Makino T. Open reading frame dominance indicates protein-coding potential of RNAs. EMBO Rep. 23(6):e54321 (2022)
- Matsuo T, Nakatani K, Setoguchi T, Matsuo K, Tamada T*, Suenaga Y*. Secondary Structure of Human De Novo Evolved Gene Product NCYM Analyzed by Vacuum-Ultraviolet Circular Dichroism. Front Oncol. 11:688852 (2021)
- Suenaga Y*, Yamamoto M, Sakuma T, Sasada M, Fukai F, Ohira M, Yamaguchi Y, Yamamoto T, Ando K, Ozaki T, Nakagawara A*. TAp63 represses transcription of MYCN/NCYM gene and its high levels of expression are associated with favorable outcome in neuroblastoma. Biochem Biophys Res Commun. 518(2):311-318 (2019)
- Suenaga Y, Islam SM, Alagu J, Kaneko Y, Kato M, Tanaka Y, Kawana H, Hossain S, Matsumoto D, Yamamoto M, Shoji W, Itami M, Shibata T, Nakamura Y, Ohira M, Haraguchi S, Takatori A, Nakagawara A*. NCYM, a Cis-antisense gene of MYCN, encodes a de novo evolved protein that inhibits GSK3β resulting in the stabilization of MYCN in human neuroblastomas. PLoS Genet. 10(1):e1003996 (2014)
- Suenaga Y, Ozaki T, Tanaka Y, Bu Y, Kamijo T, Tokuhisa T, Nakagawara A*, Tamura TA*. TATA-binding Protein (TBP)-like Protein Is Engaged in Etoposide-induced Apoptosis through Transcriptional Activation of Human TAp63 Gene. J Biol Chem. 284(51):35433-40 (2009)
- Suenaga Y, Kaneko Y, Matsumoto D, Hossain MS, Ozaki T, Nakagawara A*. Positive auto-regulation of MYCN in human neuroblastoma. Biochem Biophys Res Commun. 390(1):21-6 (2009)