細胞治療開発研究部

研究室紹介
千葉県がんセンター研究所・細胞治療開発研究部は、がん専門病院併設の利点を活かし、臨床現場の課題に直結する研究を推進しています。当研究部は研究所発足時に田中昇先生のもと「病理研究部」として始まり、その後、丸山孝士先生、田川雅敏先生へと継承されました。2019年には冨樫庸介先生(現・岡山大学)が着任し、「細胞治療開発研究部」として腫瘍免疫研究を力強く展開しました。2021年9月からは河津が部長を務め、伝統を大切にしつつ、新しい技術を積極的に取り入れて研究基盤の強化と発展を図っています。
ヒトの細胞には、設計図とプログラムに相当する「ゲノム」が備わり、その情報に基づいて細胞はつくられ、機能します。しかし、がん細胞ではゲノムの異常により、その仕組みが損なわれます。私たちのグループは、がん細胞のゲノム異常を同定し、発症メカニズムの理解から新たな治療法の創出へとつなげることを目標に掲げています。がんセンターにおける理想的な研究の進め方として、臨床医と緊密に連携し、臨床検体の収集ー核酸抽出・調整ーゲノム解析までを自らの手で一貫して実施します。疾患像を具体的に捉えながら病態解明を進めることで、臨床に還元可能な知見の獲得をめざします。
がんゲノム解析は学術的な意義にとどまらず、医療現場にも直接的な貢献が期待される分野です。ゲノムの本質を深く理解し、それに立脚した解析を通じて、未解明の病態を明らかにし、実臨床へと橋渡しする成果の創出を目指します。
熱意ある皆さまの参加を歓迎します。どうぞお気軽にご連絡ください。
構成メンバー
| 部長 | 河津 正人 |
|---|---|
| 研究員 | 盛永 敬郎 |
| 会計年度任用職員 | 2名 |
| 派遣職員 | 1名 |
| 研修生 | 5名 |
プロジェクト紹介
(1)子宮体がんの発生メカニズムを明らかにする研究
私たちは、実際の子宮体がんの手術検体を用いて、がんがどのように生まれ、どのように進んでいくのかを調べています。特に、「どの細胞が最初の“がんの芽”になるのか」「その出発点の違いで、病気の進み方も変わるのか」といった点に関心があります。また、肥満や糖尿病などの生活習慣病が子宮体がんの発生にどのように関連するのか、さらに、細胞の設計図である DNA に付く“メチル化”という化学的な目印が、発がんのスイッチとしてどのように働くのかも明らかにしたいと考えています。
手術でとれた子宮体がんの組織から複数の部位を細かく集めて解析した結果、がんの元になる細胞の集団(クローン)が、子宮の広い範囲にわたって少しずつ増えながら、新しい変異を獲得して多様化していくことが分かってきました。1個1個の細胞の状態を詳しく調べる技術(単一細胞解析)も組み合わせ、子宮体がんの成り立ちを細胞レベルで解明することを目指しています。
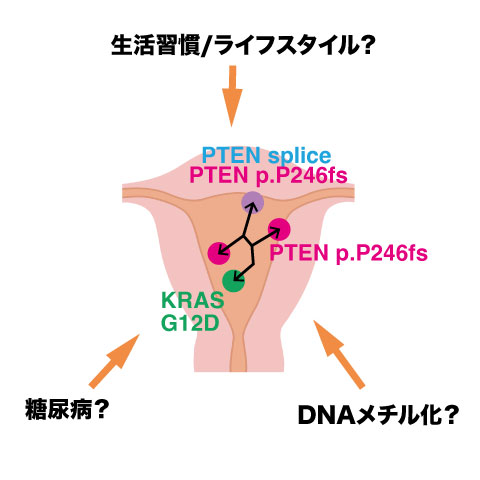
図1. 子宮体がんの発生メカニズムの解明
子宮内で、同じ起源のがん細胞クローンがPTENやKRASの異常を獲得しながら広がることを明らかにしました。一方で、発がんや進展の過程に生活習慣や糖尿病、DNAメチル化がどのように関わるのかは今後の課題です。
(2)ロングリードシーケンサーを使ったがん解析の研究
がんの成り立ちをより正確に理解するために、「ロングリードシーケンサー」という最新の遺伝子解析技術を活用しています。これは、がん細胞のDNAやRNAを長いまま読み取ることができる装置で、従来の方法ではバラバラに切れて見えていた情報を、一本の連続した情報としてとらえることができます。この技術を使うことで、がん細胞の遺伝子にどのような壊れ方が起きているか、どのような特別な型の遺伝子産物(アイソフォームと呼ばれます)が作られているか、そしてDNAにどのような「化学的な目印(DNAメチル化)」がついてスイッチのオン・オフを変えているか、といったことを同時に調べることが可能になります。単に「どの遺伝子が多い/少ない」を見るのではなく、「がん細胞は遺伝子をどう使い方を変えて別の性質(増えやすい、転移しやすいなど)を獲得しているのか」を明らかにし、将来の診断や治療法の開発につなげることを目標としています。
(3)TNS3-Sという分子に注目した乳がん転移の研究
ロングリードシーケンサーを用いた解析から、TNS3という遺伝子から生まれる「TNS3-S」という特別なかたち(アイソフォーム)を見いだしました。トリプルネガティブ乳がんは再発や転移を起こしやすい一方で、有効な薬がまだ限られているタイプの乳がんですが、TNS3-Sは、まさにこのタイプの中でも転移しやすい細胞でより多く作られていることが分かりました。TNS3-Sは、がん細胞が別の臓器(特に肺)にたどり着いたあと、そこで生き残り増えるのを助けていることがわかってきました。具体的には、細胞どうしや周囲との「くっつき(接着)」に関わるFAKという分子を安定させることで、がん細胞が死ににくくなり、成長しやすくなると考えられます。
このTNS3-Sは正常な組織ではほとんど見られず、転移したがんで目立って増えることから、将来、転移しやすいがん細胞を見つける目印(バイオマーカー)や、新しい治療標的になる可能性があります。
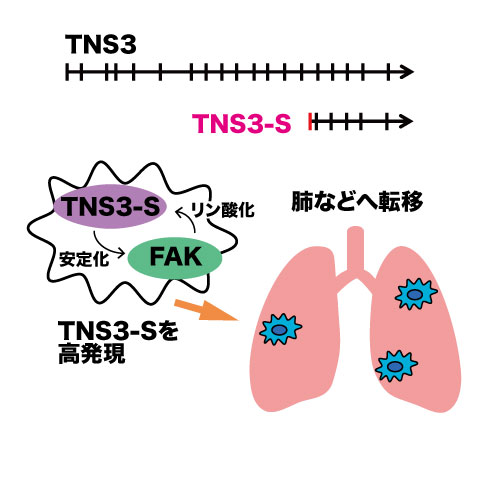
図2. TNS3-Sによる転移促進機構の解明
転移しやすい乳がん細胞で多く作られるTNS3-Sという分子を特定し、TNS3-SがFAKを安定させることで、肺でのがん細胞の生き残りと増殖を助けることを示しました。TNS3-Sが転移の早期発見マーカーや治療標的になり得るか検証を進める予定です。
業績
- Mogi M, Kawase K, Tanaka HY, Miyata S, Takemoto S, Ikeda H, Katayama E, Nakamura Y, Kojima R, Morinaga T, Tanabe S, Yonekura S, Kano MR, Hanazawa T, Kawazu M*. Pan-cancer analysis of RNA expression signatures associated with cancer tissue architecture. Br. J. Cancer 2025, in press.
- Mukohara F, Iwata K, Ishino T, Inozume T, Nagasaki J, Ueda Y, Suzawa K, Ueno T, Ikeda H, Kawase K, Saeki Y, Kawashima S, Yamashita K, Kawahara Y, Nakamura Y, Honobe-Tabuchi A, Watanabe H, Dansako H, Kawamura T, Suzuki Y, Honda H, Mano H, Toyooka S, Kawazu M*, Togashi Y*. Somatic mutations in tumor-infiltrating lymphocytes impact on antitumor immunity. Proc. Natl. Acad. Sci. U.S.A. 121(35):e2320189121 (2024).
- Kawase K, Taguchi A, Ishizaka A, Lin J, Ueno T, Yoshimoto D, Eguchi S, Mori S, Sone K, Mori M, Yonekura S, Hanazawa T, Maeda D, Kukimoto I, Mano H, Osuga Y, Kawana K, Kawazu M*. Allelic loss of HLA class I facilitates evasion from immune surveillance in cervical intraepithelial neoplasia. HLA 103(6), e15509 (2024).
- Naoi Y, Morinaga T (co-first), Nagasaki J, Ariyasu R, Ueda Y, Yamashita K, Zhou W, Kawashima S, Kawase K, Honobe-Tabuchi A, Ohnuma T, Kawamura T, Umeda Y, Kawahara Y, Nakamura Y, Kiniwa Y, Yamasaki O, Fukushima S, Kawazu M, Suzuki Y, Nishikawa H, Hanazawa T, Ando M, Inozume T, Togashi Y. CD106 in Tumor-Specific Exhausted CD8+ T Cells Mediates Immunosuppression by Inhibiting TCR Signaling. Cancer Res. 84(13):2109-2122 (2024).
- Ishino T, Kawashima S, Tanji E, Ueno T, Ueda Y, Ogasawara S, Sato K, Mano H, Ishihara S, Kato N, Kawazu M*, Togashi Y*. Somatic mutations can induce a noninflamed tumour microenvironment via their original gene functions, despite deriving neoantigens. Br. J. Cancer 128(6), 1166-1175 (2023).
- Kawazu M*, Ueno T, Saeki K, Sax N, Togashi Y, Kaneseki T, Chida K, Kishigami F, Sato K, Kojima S, Otsuka M, Kawazoe A, Nishinakamura H, Maeda Y, Yamamoto Y, Yamashita K, Inoue S, Tanegashima T, Matsubara D, Tane K, Tanaka Y, Iinuma H, Hashiguchi Y, Hazama S, Khor SS, Tokunaga K, Tsuboi M, Niki T, Eto M, Shitara K, Torigoe T, Ishihara S, Aburatani H, Haeno H, Nishikawa H, Mano H. HLA Class I analysis provides insight into the genetic and epigenetic background of immune evasion in colorectal cancer with high microsatellite instability. Gastroenterology 162(3), 799-812, (2022).
- Kishigami F, Tanaka Y, Yamamoto Y, Ueno T, Kojima S, Sato K, Inoue S, Sugaya S, Ishihara S, Mano H, Kawazu M*. Exploration of predictive biomarkers for postoperative recurrence of stage II/III colorectal cancer using genomic sequencing. Cancer Med. 11(18), 3457-3470 (2022).
- Namba S, Ueno T, Kojima S, Kobayashi K, Kawase K, Tanaka Y, Inoue S, Kishigami F, Kawashima S, Maeda N, Ogawa T, Hazama S, Togashi Y, Ando M, Shiraishi Y, Mano H, Kawazu M*. Transcript-targeted analysis reveals isoform alterations and double-hop fusions in breast cancer. Commun. Biol. 4(1), 1320, (2021).
- Chida K, Kawazoe A, Kawazu M (co-first), Suzuki T, Nakamura Y, Nakatsura T, Kuwata T, Ueno T, Kuboki Y, Kotani D, Kojima T, Taniguchi H, Mano H, Ikeda M, Shitara K, Endo I, Yoshino T. A Low Tumor Mutational Burden and PTEN Mutations Are Predictors of a Negative Response to PD-1 Blockade in MSI-H/dMMR Gastrointestinal Tumors. Clin. Cancer Res. 27, 3714-3724 (2021).
- Sato K, Kawazu M*, Yamamoto Y, Ueno T, Kojima S, Nagae G, Abe H, Soda M, Oga T,Kohsaka S, Sai E, Yamashita Y, Iinuma H, Fukayama M, Aburatani H, Watanabe T, Mano H. Fusion kinases identified by genomic analyses of sporadic microsatellite instability-high colorectal cancers. Clin. Cancer Res. 25, 378-389 (2019).