ここから本文です。
ホーム > くらし・福祉・健康 > 健康・医療 > 医薬品・医療機器 > 医薬品 > 製造販売業・製造業・修理業関係について(医薬品・医療機器・医薬部外品・化粧品・体外診断用医薬品) > 医薬品・医薬部外品の適合性調査について
更新日:令和8(2026)年2月5日
ページ番号:3893
医薬品・医薬部外品の適合性調査について
医薬品、医薬部外品の適合性調査に関するページです。
医薬品(体外診断用医薬品を除く)、医薬部外品の適合性調査(GMP)
医薬品(体外診断用医薬品を除く)・医薬部外品(以下、医薬品等という。)製造販売業者が医薬品等を新たに製造販売したり、医薬品等製造業者が海外へ医薬品等を新たに輸出する場合には医薬品医療機器等法第14条、第80条の規定により、その医薬品等を製造する医薬品等製造所においてGMP適合を確認しなければならず、そのGMP適合性を確認するために実施される調査がGMP適合性調査です。本調査は医薬品等製造販売業者が承認を継続させるため5年ごとに受ける必要があり、一変承認申請時にも実施される場合があります。医薬品等の中にはGMP省令の適用を受けない物もあるため、事前にご確認ください。
(参考:GMP省令の適用を受けない医薬品)
根拠:医薬品医療機器等法施行令第20条第1項
- 一:専らねずみ、はえ、蚊、のみその他これらに類する生物の防除のために使用されることが目的とされている医薬品のうち、人又は動物の身体に直接使用されることのないもの
- 二:専ら殺菌又は消毒に使用されることが目的とされている医薬品のうち、人又は動物の身体に直接使用されることのないもの
- 三:専ら前二号に掲げる医薬品の製造の用に供されることが目的とされている原薬たる医薬品
- 四:生薬を粉末にし、又は刻む工程のみを行う製造所において製造される医薬品
- 五:薬局製造販売医薬品
- 六:医療又は獣医療の用に供するガス類のうち、厚生労働大臣が指定するもの
- 七:前各号に掲げるもののほか、日本薬局方に収められている物のうち、人体に対する作用が緩和なものとして厚生労働大臣が指定するもの
- 八:専ら動物の疾病の診断に使用されることが目的とされている医薬品のうち、動物の身体に直接使用されることのないもの
- 九:専ら動物のために使用されることが目的とされているカルシウム剤のうち、石灰岩又は貝殻その他のカルシウム化合物を物理的に粉砕選別して製造されるもの
当県に申請される方へ
まず、当課へ事前相談をお願いします。
電話、或いは受付日(火曜日、金曜日)にご来庁の上、相談ください。その際、調査方法の決定(実地か書面か)や調査日の決定、その後の流れについて説明します。その後の流れは以下の図に示すとおりになりますので参考にしてください。なお、事前相談及び申請でご来庁の際は、必ず事前に電話によりご連絡の上お越しください。
また、医療用後発医薬品の新規承認申請に係る適合性調査申請は例年調査の予約が混みあいますので、お早めに相談いただくようお願いします。
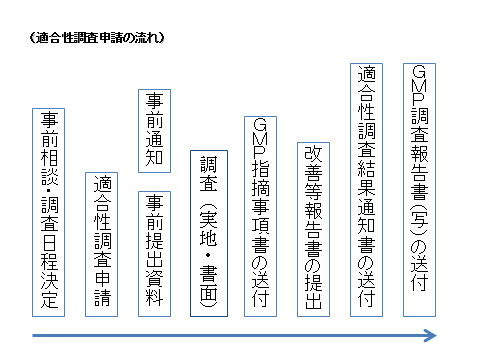
- ※1:事前相談は時期に余裕をもって行ってください。
- ※2:適合性調査申請は概ね2週間前までに行ってください。
- ※3:事前提出資料は概ね2週間前までに提出してください。
- ※4:GMP調査報告書(写)は実地調査の場合のみ送付します。
適合性調査申請時の添付資料
A:新規調査
製造販売承認申請、一変承認申請及び輸出用医薬品等の輸出届出に伴う適合性調査
- 1当該適合性調査の申請の日から過去2年間に実施されたGMP/QMS調査に係る適合性調査結果通知書又は調査報告書の写し(他の適合性調査権者等が実施した調査を含みます。)
- 2申請品目の製造販売承認申請書の写し(輸出用医薬品等の製造届に基づく場合は、その届出書の写し)(調査時点での承認内容の分かるもの)
B:定期調査
製造販売承認後5年ごと及び輸出用医薬品等の輸出届出後5年ごとに実施する適合性調査
- 1:当該適合性調査の申請の日から過去2年間に実施されたGMP/QMS調査に係る適合性調査結果通知書又は調査報告書の写し(他の適合性調査権者等が実施した調査を含みます。)
- 2:製造販売承認書(輸出用医薬品等の輸出届出に基づく場合は、その届出書)の写し
- 3:過去5年間の一変承認書の写し
- 4:過去5年間の軽微変更届書の写し
- 5:二以上の品目に係る申請を同時に行うときは、作業所、作業室、区域、設備等により分類し、その分類ごとに代表的な製品を選定し、その分類及び選定の根拠を示した資料
- 6:過去5年間の申請品目に係る回収の有無(有の場合は、その概要)
- 7:宣誓書(別紙1-3-1)(ワード:54KB)
- 宣誓書(別紙1-3-1)(PDF:48.7KB)
※1から4について、代表製品を選定した場合においては、当該代表製品に係るものに限定して差し支えありません。
なお、適合性調査申請は受付日(火曜日・金曜日)に当課まで直接来庁の上行ってください。郵送による申請は受付けておりませんのでご注意願います。また、調査後に発出する適合性調査結果通知書も原則として当課まで直接来庁の上、交付となります。事業所が遠方にあり、来庁が困難である等やむを得ない場合につきましては、申請時に必要となる分の切手を貼り付けたA4サイズの用紙が入る返信用封筒(角形2号)を一緒に提出してください。
申請手数料
申請手数料は千葉県収入証紙で納入してください。千葉県収入証紙は県庁内のほか、各出先機関等でも販売しています。詳しい販売場所については、以下の千葉県出納局のページを参照してください。なお、申請時には収入証紙は貼らずに持参ください。
また、申請手数料については医薬品等製造販売業・製造業・修理業関係申請手数料を参照してください。
千葉県出納局:(千葉県収入証紙について)
事前提出資料について
適合性調査申請の後、調査日の2週間前までを目安にGMP調査に係る事前提出資料をご提出ください。事前提出資料については適合性調査申請と同時に提出しても構いません。提出いただきたい資料は以下のとおりですので、提出の前にご確認ください。
※事前提出資料「10 その他必要な書類」の「変更管理の実施状況の一覧」及び「逸脱管理の実施状況の一覧」について、品質へ与える影響等からランク分けをされている場合、ランク分けの定義・考え方について記載してください。また、事例ごとにランクを記載してください。
適合性調査実施後
調査実施後、約2週間を目安として製造所宛てで調査結果を通知します。調査結果については、指摘事項があった場合は、所定様式を使用して改善計画又は改善報告を行ってください。
- 別紙5(改善計画書/改善結果報告書様式)(別紙5(改善計画書/改善結果報告書様式)(ワード:25.1KB)(別紙5(改善計画書/改善結果報告書様式)(PDF:40.8KB))
なお、適合性調査結果の評価基準については、以下の通知を参照してください。
平成24年2月16日付け薬食監麻発0216第7号厚生労働省医薬食品局監視指導・麻薬対策課長通知
お問い合わせ
より良いウェブサイトにするためにみなさまのご意見をお聞かせください
