腫瘍ゲノム研究室

腫瘍ゲノム研究室の室長を務めている下里修です。私は千葉県にある東邦大学・理学部・生物分子科学科ならびに同大学・大学院理学研究科・修士課程に進学し、生命科学の基礎を学びました。大学での専門的な講義を受けていく中で、「免疫学」と「分子生物学」に大きな魅力を感じたので、学部4年生の卒業研究と修士課程では免疫反応を制御するサイトカインの研究に従事しました。さらなる研鑚を積むべく、順天堂大学・大学院医学研究科・博士課程へ進学し、1999年に学位取得後は米国へ留学する機会を得ました。その中で、血液細胞の一つであるT細胞が免疫反応を制御する仕組みやサイトカインの一つであるインターフェロンγが免疫機能を担うナチュラルキラー細胞の分化に及ぼす影響を明らかにしました。2001年の帰国と同時に千葉県がんセンターへ赴任し、2017年から現職を拝命し、現在に至ります。
人を死に至らしめる「がん」という病気は、手術以外の治療法で完治させることは非常に難しく、いったん回復しても数年後に再発する場合が多く見られます。孫子・謀攻編にある「彼を知り己を知れば百戦殆からず」という格言が示すように、「がん」という病気を治すためにはがん細胞のことをよく理解する必要があると考え、私は「がん幹細胞」の研究を開始しました。「がん幹細胞」とは2000年代初めに提唱された仮説です。正常な組織の母体であり、様々なストレスに対する抵抗性を持つ「組織幹細胞」になぞらえて、がんの発生や再発の原因として、がん組織の母体となる特殊ながん細胞、すなわち「がん幹細胞」、の存在する可能性が示唆されています。私はまず初めに、「がん幹細胞」と通常のがん細胞を見分ける目印としてCD133と呼ばれる蛋白質の機能を調べました。その成果として、「がん幹細胞」の悪い性質(がんの発生や治療抵抗性など)を発揮する際のCD133の役割とその仕組みを分子レベルで明らかにし、世界に先駆けて報告いたしました。また、がん幹細胞が治療抵抗性を持つ仕組みを明らかにするための研究を行っています。
がん研究の歴史を振り返ると、遺伝子解析との密接な関係が見られます。1970年代に遺伝子を細胞へ導入する手法が開発されると「がん遺伝子」の発見につながり、1990年代のマイクロアレイ法といった遺伝子を網羅的に解析する手法の開発は、遺伝子レベルでのがん組織の多様性が明らかになりました。2000年代に入り次世代シーケンサーが登場すると、がん組織内の個々のがん細胞の間にも個体差のあることが明らかになりつつあります。当研究所でも、久光製薬との共同研究施設として「遺伝子機能解析センター」を2001年に開設し、このような遺伝子解析技術を取り入れてきました。当時の生化学研究部に所属されていた大平美紀上席研究員(現埼玉県立がんセンター臨床腫瘍研究所)が、2005年に当研究室の前身となる「ゲノムセンター研究室(2008年、がんゲノム研究室に改称)」の初代室長に昇進され、現在のがん遺伝子検査に通じるような、前述のマイクロアレイ技術を応用した予後(治療後の経過を指す)を予測する診断システムを構築されました。私も、研究室の創設以来の使命を引き継ぎ、がんの撲滅に貢献するべく、診断法および治療法の確立に向けた基礎研究を推進したいと考えております。
メンバー
| 室長 | 下里 修 |
|---|
プロジェクト紹介
新規治療薬・診断法開発を目指し、がん幹細胞の持つ特性を解明する
化学療法および放射線照射などの治療によって、多くの場合がんは消滅します。しかし、残念ながら数年後に再発する場合があります。このとき組織内のがん細胞は、様々な方法で抵抗性を獲得すると考えられてきました。しかし近年、「がん組織には治療抵抗性の高い特殊ながん細胞が一定の割合で存在する」という考え方が提唱されています。この特殊ながん細胞は「がん幹細胞」と呼ばれ、最近のがん研究のトレンドになります。当研究室では、将来の治療薬・診断法開発を目指し、がん幹細胞の持つ特性、特に治療抵抗性の仕組みの究明に努めています。
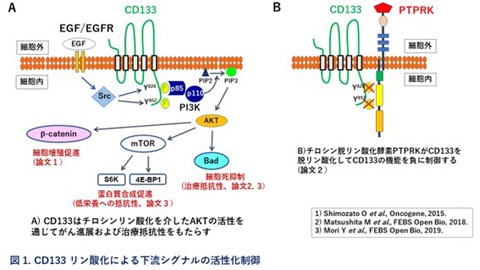
1. がん幹細胞マーカーCD133の機能解析
CD133とは細胞の表面上に発現する蛋白質の一つです。血液を始め、様々な正常組織の幹細胞が特徴的に発現する蛋白質として見つかりました。また、多くの癌腫において、CD133陽性のがん細胞は高い腫瘍形成能力と治療抵抗性を持つことが示されたことから、がん幹細胞を見分ける見印として考えられています。しかし、その機能には不明な点が残されています。私たちは、大腸がん細胞をモデルに用いてCD133の機能解析に取り組み、がん幹細胞の特性である腫瘍形成能力と治療抵抗性を発揮する上で重要な蛋白質であることを明らかにしています(図1)。
2. エピゲノム的薬剤抵抗性の解明
がんの治療抵抗性の獲得には、様々な機能を持つ蛋白質の関与が報告されています。例えば、薬剤を細胞外へ排出するポンプや薬剤を代謝して無毒化する酵素などが、治療抵抗性を示すがん細胞で高く発現していることが知られています。通常、蛋白質は遺伝子としてDNAにコードされ、必要に応じてその情報がmRNAに転写され、蛋白質が合成されます。mRNA合成の制御機構は、例えば転写制御因子が結合するプロモーターのようにDNAの塩基配列による場合と、DNAとその周囲にある蛋白質への化学修飾によるものがあります。後者は、DNAにコードされる情報(ゲノム)とは異なる仕組みであることからエピゲノム的制御と呼ばれ、近年注目されています(図2)。この中で私たちは、ヒストン蛋白質の一つであるH3のアミノ末端から4番目のリジン残基で見られるメチル化修飾に関る酵素の機能に焦点を当てて解析しています(図2)。

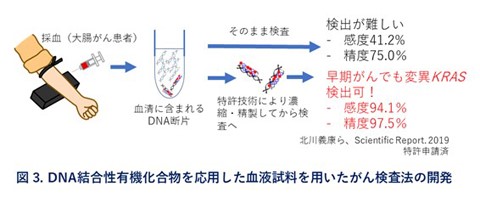
3. 血液試料を用いたがん検査法の開発
様々な要因で体内の細胞が壊れると、無細胞遊離核酸(cell-free DNA, cfDNA)と呼ばれるDNA断片が血液中に放出されます。がん患者の場合、がん細胞から放出された遺伝情報に変異の入ったcfDNAが含まれます。このがん細胞に由来するcfDNAは、血中循環腫瘍DNA(circulating tumor DNA, ctDNA)と呼ばれ、適応するにはいくつかの条件を満たす必要がありますが、実際のがん遺伝子パネル検査にも応用されています。また、遺伝情報は元のがん細胞の特徴を反映するので、高精度のがん検診が可能になると期待されています。しかし、血液中のctDNAの存在量が極めて少ないので、正確に検出するためには工夫が必要と考えます。私たちは、塩基配列選択的にDNAと結合する有機化合物を使ってctDNAを濃縮し、変異DNAの検出力を高める技術を開発しています(図3)。現在も、発がんに関与するがんドライバー遺伝子や代謝酵素の検出を目指して開発を進めています。
最近の主な業績
- Kitagawa Y et al. Enrichment technique to allow early detection and monitor emergence of KRAS mutation in response to treatment. Sci Rep., 2019;9:11346.
- Matsushita M et al. PTPRK suppresses progression and chemo-resistance of colon cancer cells via direct inhibition of pro-oncogenic CD133.FEBS Open Bio, 2019;9:935-946.
- Inoue T et al. Hydrophobic structure of hairpin ten-ring pyrrole-imidazole polyamides enhances tumor tissue accumulation/retention in vivo. Bioorg. Med. Chem., 2018;26:2337-2344.
- Sun Y et al. Cancer-type OATP1B3mRNA has the potential to become a detection and prognostic biomarker for human colorectal cancer. Biomark Med., 2017;11.
- Islam MS et al. Transcriptional regulation of BMCC1mediated by E2F1in neuroblastoma cells. Biochem Biophys Res Commun., 2016;478:81-86.
- Tatsumi Y et al. BMCC1,which is an interacting partner of BCL2,attenuates AKT activity, accompanied by apoptosis. Cell Death Dis, 2015;6:e1607
- Shimozato O et al. Receptor-type protein tyrosine phosphatase kappa directly dephosphorylates CD133and regulates downstream AKT activation. Oncogene, 2015;34:1949-1960.